*通信作者简介:姜培坤(1963- ),男,浙江桐乡人,教授,主要研究土壤质量与环境学。E-mail:jiangpeikun@zafu.edu.cn
第一作者简介:应雨骐(1990- ),女,浙江衢州人,硕士研究生,主要研究森林土壤质量与环境学。E-mail:yingyuqi0614@163.com
研究选取中国亚热带阔叶林、针叶林、竹林等3种森林类型中常见的7个树种,通过微波消解法提取其植硅体,并对其植硅体中碳含量进行测定,计算植硅体产量并估测碳封存量,结果表明:① 7个树种叶子植硅体碳占干物质含量分别为毛竹3.31±0.53 g·kg-1、杉木0.30±0.06 g·kg-1、马尾松0.40±0.11 g·kg-1、苦槠0.19±0.04 g·kg-1、青冈0.88±0.09 g·kg-1、木荷0.49±0.18 g·kg-1、枫香1.12±0.33 g·kg-1;② 相关分析表明,硅与植硅体含量( P<0.05, R2=0.989 7)、植硅体与植硅体碳占物质含量( P<0.05, R2=0.881 6)、植硅体碳与植硅体碳占干物质含量( P<0.05, R2=0.354 4)之间的相关性达显著水平。③ 毛竹的植硅体碳封存速率最高,若以最高植硅体碳封存速率0.050 6 t- e-CO2·hm-2·a-1计算,面积为3.87×106 hm2的毛竹林每年可封存约1.96×105 t CO2;④ 杉木、马尾松的植硅体碳封存速率分别为0.005 6和0.010 8 t-e-CO2·hm-2·a-1,面积分别为1.13×107、1.20×107 hm2的杉木林、马尾松林每年可封存约6.33×104、1.30×105 t CO2;⑤ 阔叶林植硅体碳封存速率介于0.000 5~0.019 3 t-e-CO2·hm-2·a-1之间,面积为2.49×107 hm2的阔叶林每年可封存1.25×104~48.15×104 t CO2。
In this study, seven tree species including broad-leaved forest, coniferous forest, and bamboo forest in subtropical China were selected as experimental materials. The phytolith in the plants was extracted through a microwave digestion method and the phytolith occluded carbon (PhytOC) concentrations in the leaves were determined. The results showed that: 1) all the seven tree species had the potential of carbon bio-sequestration within phytoliths. The PhytOC concentrations in dry leaf biomass of different tree species were in the following order: Phyllostachys pubescens (3.31 ± 0.53 g·kg-1) > Liquidambar formosana (1.12 ± 0.33 g·kg-1) > Cyclobalanopsis glaua (0.88 ± 0.09 g·kg-1) > Schima superba (0.49 ± 0.18 g·kg-1) > Pinus massoniana (0.40 ± 0.11 g·kg-1) > Cunninghamia lanceolata (0.30 ± 0.06 g·kg-1) > Castanopsis sclerophylla (0.19 ± 0.04 g·kg-1). 2) There were strong linear relationships between Si concentrations and phytolith concentrations ( P<0.05, R2=0.9897), phytolith concentrations and PhytOC concentrations in the leaf dry weight ( P<0.05, R2=0.8816), PhytOC concentrations in phytoliths and PhytOC in the leaf dry weight ( P<0.05, R2=0.3544). 3) Phyllostachys pubescens had the highest PhytOC fluxes (0.0506 t-e-CO2·hm-2·a-1), bio-sequestration via phytolith carbon from leaf-litter under 3.87×106 hm2 of Phyllostachys pubescens stands in subtropical China is estimated to be about 1.96×105 t CO2. 4) The phytoliths carbon bio-sequestration flux of Cunninghamia lanceolata and Pinus massoniana were 0.0056 and 0.0108 t-e-CO2·hm-2·a-1, respectively, bio-sequestration via phytolith carbon from leaf-litter under 1.13×107 and 1.20×107 hm2 of Cunninghamia lanceolata and Pinus massoniana stands is estimated to be about about 6.33×104 and 1.30×105t CO2, respectively. 5) The phytoliths carbon bio-sequestration flux of broad-leaved forests ranged from 0.0005 to 0.0193 t-e-CO2·hm-2, bio-sequestration via phytolith carbon from leaf-litter under 2.49×107 hm2 of broad-leaved forests in subtropical China is estimated to be about 1.25×104-48.15×104 t CO2.
森林生态系统是陆地生态系统中最重要的碳汇[1], 在维持全球碳平衡、减缓CO2浓度上升等方面起着重要的作用, 已成为国内外学者研究的热点。中国亚热带森林面积达2.5× 108 hm2, 在全球森林生态系统中发挥着独特的作用[2]。
植硅体(phytolith), 又称植物蛋白石, 它是在蒸腾作用下, 伴随高等植物吸收水分而吸收、沉淀、积累在植物细胞内或细胞间隙中的非晶质的含水二氧化硅矿物[3]。而植硅体碳(PhytOC)是指在这一过程中, 被封存在植硅体中的少量有机碳。根据王永吉等[4]的研究, 植硅体具有耐高温、抗腐蚀的特性, 在700 ℃下加热, 其物理、化学性质也不会发生较大改变。因此, 在植物死亡后, 植硅体能够在土壤中长久存在。植硅体碳由于受到植硅体的保护, 也能够在土壤中存在长达数千年之久, 在第三纪[5]乃至晚白垩纪[6]的地层中都有发现。国内外学者已对植硅体碳进行了相关研究, 发现大多数植物的植硅体中都含有碳元素, 且不同种之间差异较大, 玉米(Zea mays)、小麦(Triticum aestivumLinn)、苦竹(Pleioblastus amarus)、钱线蕨(Adiantum)的植硅体碳含量分别为4.40、8.40、192.40、393.00 g· kg-1 [7]。研究人员也对禾本科植物[8, 9, 10]及以草本植物为主的湿地植物[11]等进行了宏观的植硅体碳封存估测, 全球5.70× 108 hm2的湿地植物每年能固定大气中高达4.39× 107 t的CO2, 相当于吸收了大约1.69× 107 t标准煤燃烧所排放的CO2[11]。但总结国内外学者的研究, 关于亚热带重要树种植硅体碳封存潜力方面鲜见报道。
中国亚热带森林面积广阔, 植被类型丰富, 凋落物量巨大, 而凋落物中, 叶子又占有绝对优势[12], 因此每年可能会通过叶片凋落, 以植硅体碳形式封存大量的CO2。本文选取我国亚热带3种重要森林类型[13, 14]— — 阔叶林、针叶林、竹林, 选择其中主要的7个树种进行研究, 旨在分析比较不同树种的植硅体碳含量, 并按不同林分类型进行碳封存估测, 为进一步准确估测我国亚热带森林生态系统植硅体碳封存潜力提供基础。
试验地位于浙江省临安市青山镇(119° 42′ E, 30° 14′ N), 属典型亚热带季风气候, 年平均气温16.4 ℃, 极端最高气温41.7 ℃, 极端最低气温-13.3 ℃, 年平均有效积温5 774 ℃, 年平均降水量1 628 mm, 年平均日照时数1 774 h, 无霜期235 d。土壤为发育于砂岩红壤土类。
研究地点包括阔叶林、针叶林、竹林这3个亚热带森林类型, 从中选取7个常见树种。所有林分位于海拔60~140 m, 坡度15° , 坡向东北坡, 郁闭度为0.7, 毛竹为3 a生, 其他树种的年龄介于15~20 a。
对每种林分分别设3个20 m× 20 m样方, 进行样地调查, 计算林分中不同树种的平均胸径(表1), 选取平均胸径一致(相似)的3株树木作为标准株, 将标准株砍伐, 分上、中、下3个部位摘取叶片, 均匀分取叶样品500~1 000 g(准确称重)于样品袋中, 带回实验室分析[15]。
| 表 1 7个主要树种基本情况 Table 1 The basic information of seven tree species |
凋落物作为森林生态系统和土壤之间的重要“ 纽带” , 每年通过叶片的凋落将植硅体归还到土壤中, 是森林生态系统碳封存的一种途径[10]。因此, 本文选用年凋落物量来估测亚热带重要树种的碳封存潜力, 7个树种年凋落物量及其组成的林分所占面积的数据来自于前人对亚热带森林生态系统所作的大量研究与统计(表1)。
叶片样品取回后, 用去离子水洗净, 在105 ℃下杀青, 70 ℃下烘干至恒重, 称重, 计算含水率。烘干的样品用高速粉碎机粉碎后用塑封袋保存备用。
将处理好的样品分为3份, 1份用Elementar Vario MAX CN碳氮元素分析仪(德国Elementar公司)测定C、N含量; 1份采用偏硼酸锂熔融-硝酸缓冲液提取-钼蓝比色法测定Si元素的含量; 1份用来提取植硅体并测定植硅体碳含量。植硅体的提取采用微波消解法[21], 后用比重1.5~1.7左右的重液浮选[3], 除去上浮部分, 将下沉的部分用酒精和水冲洗, 确保有机质被全部除去, 干燥称重。植硅体碳的测定方法在前人的基础上[22]略有改进, 具体如下:① 称取提取好烘干后的植硅体样品于10 ml塑料离心管中, 加入10 mol· L-1 NaOH 0.5 ml在室温下浸提3 h, 以溶解phytolith-Si[23]; ② 将浸提液全部转移入玻璃离心管, 以超纯水冲洗残留液两次(每次0.7 ml), 一并转入玻璃离心管中(冲洗次数以是否洗干净而定), 立即加入0.8 mol· L-1[c(1/6K2Cr2O7)=0.8 mol· L-1]标准溶液1.0 ml, 轻轻摇匀后加浓H2SO4 4.6 ml摇匀显色; ③ 将显色液置于98 ℃下水浴30 min。取出定容至25 ml, 充分摇匀、冷却, 2 500 r· min-1离心10 min, 1 cm光程比色皿590 nm下比色。
数据处理使用SPSS 18.0系统进行统计分析, 用Duncan新复极差法检验不同处理的差异显著性。
由表2可知, 7个树种叶片中的Si含量、总有机碳含量、植硅体含量均表现为毛竹与其余6个树种有显著的差异。其中, 毛竹的Si含量(40.11 g· kg-1)、植硅体含量(117.79 g· kg-1)在7个树种中均为最高, 但其总有机碳含量(433.93 g· kg-1)在7个树种中最低。7个树种的Si含量变化范围为1.27~40.11 g· kg-1, 总有机碳含量变化范围为433.93~487.76 g· kg-1, Si含量的变化幅度较有机碳含量大。7个树种植硅体含量变化范围为1.90~117.79 g· kg-1, 变化幅度较Si含量及总有机碳含量大, 植硅体含量最高的毛竹可达植硅体含量最低的苦槠的62倍。同时Si含量相对较高的3个树种, 其植硅体含量也表现出同样的规律。
| 表 2 7个树种Si含量、总有机碳含量、植硅体含量 Table 2 The content of Si, total organic carbon and phytolith in the seven tree species |
如表3所示, 7个树种的植硅体碳含量表现为毛竹与青冈无显著性差异, 但与其余5个树种存在显著性差异。植硅体碳含量变化范围在29.38~137.65 g· kg-1之间, 其中毛竹最低, 马尾松最高。7个树种干物质中植硅体碳的含量在0.19~3.31 g· kg-1之间, 干物质中植硅体碳占总有机碳的比例也比较明显, 在0.40~7.62 g· kg-1之间, 其中毛竹干物质中植硅体碳的含量及其在总有机碳含量中所占的比例都表现为最高。
| 表 3 7个树种的植硅体碳封存速率估测 Table 3 The estimated range of phytolith occluded carbon(PhytOC) per hectare in tonnes of carbon dioxide equivalents (t-e-CO2) of seven tree species |
研究表明, 7个树种均有一定的植硅体碳封存能力, 介于0.000 3~0.050 6 t-e-CO2· hm-2· a-1。7个树种中, 毛竹的植硅体碳封存速率最大, 平均值为0.043 7 t-e-CO2· hm-2· a-1; 苦槠的植硅体碳封存速率最小, 平均值为0.000 4 t-e-CO2· hm-2· a-1, 它们之间的差异达109倍。
植物器官中Si含量在不同植物间具有较大差异[24]。一般认为, 被子植物的Si含量要高于裸子植物, 被子植物中, 单子叶植物又较双子叶植物高, 而在单子叶植物中, 禾本科植物是陆地环境中积累高浓度硅的代表[24]。根据王永吉等[3]的研究, 植硅体含量在不同植物中的差异趋势符合前面所述Si含量在不同植物中的分布趋势。本研究中毛竹为典型禾本科植物, 苦槠、青冈、木荷、枫香为双子叶植物中的阔叶树种, 杉木、马尾松则为裸子植物的代表, 这7个树种的Si含量及植硅体含量大小排列符合前人的研究成果。王永吉等[3]的研究也指出, 植物中Si含量的大小最直接地反映了植硅体的含量, 本研究中7个树种的植硅体含量与Si含量达到显著的正相关水平(P< 0.05, R2=0.989 7)(图1), 表明随着植物富集Si能力的增强, 其植硅体含量也随之增多。
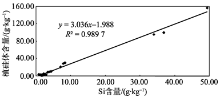 | 图1 不同树种植硅体含量和Si含量相关性分析Fig. 1 Correlation of Si and the phytolith content of biomass in the seven tree species |
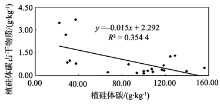
本研究结果表明, 不同树种的植硅体碳含量变化较大, 其大小趋势大致与Si含量及植硅体含量相反, 表现为裸子植物(杉木、马尾松)> 双子叶植物(苦槠、青冈、木荷、枫香)> 单子叶植物(毛竹), 这说明不同植物其植硅体碳含量也存在着差异。究竟是何因素造成了这种差异, 前人虽已有研究, 但目前还没有得到系统的解答。前人已对竹子[10]、小麦[9]、黍和粟[8]、甘蔗[25]的植硅体含量、植硅体碳含量及植硅体碳占干物质含量的相互关系进行了研究, 结果均显示它们的植硅体与植硅体碳占干物质含量无相关关系, 但其植硅体碳含量与植硅体碳占干物质含量相关。这表明, 植物的植硅体碳含量并不是由植硅体含量的多少来决定, 而是与其植硅体本身的固碳能力和效率相关。本研究对这7个树种植硅体含量、植硅体碳含量及植硅体碳占干物质含量进行相关分析。结果显示, 7个树种的植硅体与植硅体碳占干物质含量存在相关关系(P< 0.05, R2=0.881 6)(图2), 其植硅体碳含量与植硅体碳占干物质含量也相关(P< 0.05, R2=0.354 4)(图3), 与前人对竹子[8, 9, 10, 25]等的研究成果有所不同, 但与李自民等[11]对湿地植物的研究结果相符。这表明, 植物的植硅体碳含量是由植硅体含量及植硅体本身的固碳能力和效率共同决定的。究其原因, 可能是因为植硅体含量受到多种因素的控制, 这些因素包括植物种类、种植地点及不同植物对多种营养元素的需求等等[9, 11, 26]。同时, 不同植物的植硅体形状有较大差异, 其表面积也有所不同, 这可能影响了植硅体的固碳能力和效率[27, 28]。前人的研究主要集中于相同植物不同基因型之间植硅体含量、植硅体碳含量、植硅体碳占干物质含量之间的相关关系, 反映的是单一植物种类的植硅体碳封存能力, 而本研究则将7个不同树种的三个指标放在一起进行相关分析, 比较的是不同树种之间总的相互关系, 结果更能反映整个中国亚热带森林生态系统中不同林分类型的植硅体碳封存能力, 并为在以后的工作中准确估测中国亚热带森林生态系统植硅体碳封存潜力提供依据。
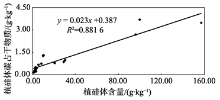 | 图2 不同树种植硅体含量和植硅体碳占干物质含量相关性分析Fig. 2 Correlation of the phytolith content of biomass and the PhytOC content of biomass in the seven tree species |
研究结果表明, 在植硅碳相关指标中毛竹与其他树种之间存在显著性差异, 其植硅体含量及植硅体碳占干物质含量都表现为最高。这表明毛竹不仅是硅富集植物, 同时毛竹植硅体具有相当大的碳封存潜力。比较前人对不同植物植硅体碳封存速率的研究成果(表4), 本研究中毛竹的封存速率大小符合Parr等[10]对12种竹子的研究结果范围, 高于黍[8]、粟[8]及草地[29]的封存速率, 介于小麦[9]、水稻[22]及湿地植物[11]的范围内, 低于甘蔗[25]的封存速率。中国亚热带毛竹林面积共3.87× 106 hm2, 以毛竹最高碳封存速率0.050 6 t-e-CO2· hm-2· a-1计算, 我国毛竹林每年可封存1.96× 105 t CO2, 大约可以抵消7.52× 104 t标准煤燃烧所排放的CO2。
| 表 4 不同植物植硅体碳封存速率比较 Table 4 Comparison of phytolith occluded carbon(PhytOC) per hectare in tonnes of carbon dioxide equivalents (t-e-CO2) in different plants |
本研究中的裸子植物(杉木、马尾松)、双子叶阔叶树种(苦槠、青冈、木荷、枫香)的植硅体碳封存速率均低于表4中所列甘蔗等[8, 9, 10, 11, 22, 25, 29]植物(其中, 木荷、枫香的平均速率与草地[29]相当), 这可能与他们的植硅体碳占干物质含量和年凋落物量的大小有关。杉木林、马尾松林及阔叶林在中国亚热带森林中分布较广、面积较大, 因而具有较大的植硅体碳年封存量。中国亚热带杉木林面积共1.13× 107 hm2, 以其最高植硅体碳封存速率0.005 6 t-e-CO2· hm-2· a-1计算, 每年可封存6.33× 104 t CO2; 马尾松林面积1.20× 107 hm2, 以最高植硅体碳封存速率0.010 8 t-e-CO2· hm-2· a-1计算, 每年可封存1.30× 105 t CO2。亚热带阔叶林2.49× 107 hm2, 树种丰富, 本研究以植硅体碳封存速率最低的苦槠(0.000 5 t-e-CO2· hm-2· a-1)及最高的枫香(0.019 3 t-e-CO2· hm-2· a-1)计算, 每年可封存1.25× 104~48.06× 104 t CO2。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|